رنگها
دیدن رنگها
اشیا به دلیل نحوه انعکاس نور از روی آنها رنگی دیده می شوند . نور سفید خورشید یا لامپ برقحاوی همه رنگهای طیف نور است . وقتی نور سفید روی یک شی می افتد ، شیئ را تشکیل می دهند. مثلاَ یک شیئ سبز رنگ شیئ است که فقط پرتوهای سبز را منعکس و بقیه را جذب می کند. شیئ که همه رنگهای طیف نور را منعکس کند سفید دیده می شود . شیئ که هیچ رنگی را منعکس نکند سیاه دیده می شود
واص رنگ ساز این مواد می پردازد ) . فیزیولوژی ، فرایند هایی را که در چشم و مغز به هنگام تحریک ناشی از تجربه ی رنگ اتفاق می افتد ، مورد مطالعه قرار می دهد . روانشناسی در مسائل آگاهی و ذهنیت نسبت به رنگ – همچون عنصری از تجربه ی بصری – بحث می کند . اشتراک اصطلاحات در این عرصه ها ، غالبا ً بر دشواری درک مفاهیم می افزاید . مطالعه ی هنری رنگ نیز مقوله ای جدا از این ملاحظات نیست ، و به خصوص رویکرد روانشناختی رنگ در این زمینه اهمیت دارد .
هر رنگ دارای سه صفت یا سه بُعد بصری مستقلا ً تغییر پذیر است : فام ، درخشندگی و اشباع .
فام ، صفتی از رنگ است که جایگاه آن را در سلسله ی رنگی ( از قرمز تا بنفش) – معادل با نور طول موج های مختلف در طیف مرئی – مشخص می کند .گفته می شود که تقریبا ً 150 فام متفاوت را می توان تشخیص داد ، ولی همه ی اینها به طور مساوی در طیف مرئی توزیع نشده اند ، زیرا چشم ما برای تفکیک فام ها در طول موج های بلند تر توانایی بیشتری دارد . بلند ترین طول موج ها در منطقه ی قرمز و کوتاه ترین طول موج ها در منطقه ی بنفش هستند . دسته بندی عمومی رنگ ها به بیفام ( سیاه ، سفید و خاکستری ها ) ، و فام دار ( قرمز ، زرد ، سبز ،...) بر همین صفت مبتنی است . برای سهولت درک مطلب ، فام را می توان مشخص کننده ی اسم عام رنگ ها تعریف کرد .
قرمز ، زرد و آبی را فام های اولیه می نامند و چون مبنای سایر فام ها هستند ، رنگ های اصلی نیز نام گرفته اند . فام های ثانویه عبارتند از : نارنجی ، سبز و بنفش که که از اختلاط مقادیر مساوی از دو فام اولیه حاصل می شوند . فام های ثالثه از اختلاط فام های اولیه و ثانویه به دست می آیند : زرد- نارنجی( پرتقالی) ،
نارنجی- قرمز ، قرمز- بنفش ( ارغوانی) ، بنفش- آبی ( لاجوردی) ، آبی- سبز (فیروزه ای) ، سبز- زرد (مغز پسته ای) . دوازده فام نامبرده را با ترتیبی معین درچرخه ی رنگ ، نشان می دهند . در چرخه ی رنگ ، فام های ثانویه و ثالثه ای که بین یک زوج فام اولیه جای گرفته اند ، دارای روابط خویشاوندی هستند و در کنارهم ساده ترین هماهنگی رنگی را پدید می آورند .
درخشندگی (والوور) ، دومین صفت رنگ است و درجه ی نسبی تیرگی و روشنی آن را مشخص می کند(غالبا ً نقاشان اصطلاح رنگسایه را نیز در همین معنا به کار می برند) . معمولا ً درخشندگی رنگ های فام دار را در قیاس با رنگ های بیفام می سنجند . در چرخه ی رنگ ، زرد بیشترین درخشندگی (معادل خاکستری روشن نزدیک به سفید) و بنفش کمترین درخشندگی ( معادل خاکستری تیره ی نزدیک به سیاه) را دارد . در سلسله ی رنگی ، هر فام نسبت به دیگری میزان تیرگی یا روشنی ذاتی اش را می نمایاند . معکوس کردن این ترتیب طبیعی ، ناسازگاری رنگی به بار می آورد (مثلا ً اگر بنفش روشن در کنار سبز زیتونی قرار گیرد ، نوعی تکان بصری ایجاد می کند) .
اشباع (پرمایگی) ، سومین صفت رنگ است و میزان خلوص فام آن را مشخص می کند ( گاه واژه ی شدت را در این مورد به کار می برند ) . فام های چرخه ی رنگ صد در صد خالص اند ولی در طبیعت به ندرت می توان فام خالصی یافت . همچنین ، کمتر رنگیزه ای حد اشباع فام مربوطه در چرخه ی رنگ را داراست .
اگر فام ها به هم آمیخته شوند ، رنگ های شکسته به دست می آیند . اختلاط فام های خالص با یکدیگر یا با رنگ های بیفام ، باعث تغییر در پرمایگی و درخشندگی شان می شوند . به طور کلی ، هر فام قابلیت ایجاد رنگ های متنوعی را در حوزه ی خود دارد که به آن تلوّن (واریاسیون ) می گویند ( مثلا ً انواع صورتی ، اُخرایی وقهوه ای ، تلوّن در فام قرمز هستند ) .
چگونگی متظاهر شدن رنگ ها از دیگر مباحث رنگ شناسی است . در تجربه ، سه نمود مختلف در رنگ ها می توان تشخیص داد : فیلمرنگ ، حجمرنگ و سطحرنگ .
فیلمرنگ ، رنگی است که در فاصله ای نا مشخص نسبت به بیننده ظاهر می شود (مثلا ً رنگی که در طیف نما اسپکتروسکوپ می توان دید ، یا رنگ آسمان خاکستری یکنواخت) . فیلمرنگ ، بافت واضحی ندارد و گویی شخص می تواند کمابیش به درون آن رسوخ کند . همواره در تراز جلو به چشم می آید . فیلمرنگ را نمی توان همچون کیفیتی در اشیاء و یا متعلق به رویه ی اشیاء دانست .
حجمرنگ را در اشیای پشت نما می توان دید ( مثلا ً در یک استکان چای یا در بخار رنگین) . حجمرنگ در فضای سه بُعدی که اشغال کرده است گسترش می یابد ، ولی تراز متغیری نسبت به چشم بیننده ندارد .
سطحرنگ ، چنان به نظر می آید که روی سطح شیء قرار گرفته است ( مثلا ً در یک کاغذ رنگی) . بافت رویه ی شیء را به خود می گیرد و حایل غیر قابل نفوذ برای چشم ایجاد می کند . سطحرنگ را معمولا ً همچون کیفیتی در خود شیء می انگاریم .
از این سه کیفیت ظاهری که اشاره کردیم ، نمود های دیگری چون تلأ لو، فروغ و فلزنما ناشی می شوند . نقاشان با سطحرنگ سر و کار دارند ولی بخشی از صناعت آنان معطوف به ایجار نمود های حجمرنگ ، فیلمرنگ ، تلأ لو و فروغ به وسیله ی رنگیزه است که در واقع چنین کیفیت هایی را ندارد . آن دسته از حجم سازان مدرن که با موادی چون پلاستیک کار می کنند ، از نمود حجمرنگ بهره می گیرند .
یکی از ملاحظات روانشناختی رنگ که در کاربرد هنری رنگ اهمیت دارد ، بررسی تأثیر متقابل رنگ ها است . جلوه یا اثر هر رنگ در جوار رنگ دیگر تغییر می کند . اگر در شرایط روشنایی مناسب ، چند ثانیه به یک رنگ فام دار خیره شویم و بی درنگ بر سطحی سفید بنگریم ، مکمل آن رنگ را خواهیم دید . این پدیده را – که ناشی از واقعیت فیزیکی رنگ عینی نیست – پی انگاره می نامند . پی انگاره ی هر رنگ ، رنگ مجاورش را تحت تأثیر قرار می دهد و در نتیجه ، تفاوت کیفی آن دو رنگ بارزتر می شود ( مثلا ً قرمز در کنار سبز ، پرمایه تر به نظر می رسد و برعکس ) . تغییری که بدین سان در جلوه ی رنگ ها پدید می آید ، مشخص کننده ی تباین آنها است . اگر موقعیت دو حوزه ی رنگی مقایسه شده چنان باشد که تغییر جلوه ی رنگ ها با هم تلاقی کند ، اصطلاح تباین همزمانبه کار برده می شود .
رویکرد روانشناختی رنگ به احساس های معینی نیز بستگی دارد که رنگ های عینی دربیننده برمی انگیزند.
به سخن دیگر ، در این مقوله ، رابطه ی رنگ های عینی با اثرات ذهنی شان مورد نظر است . رنگ هایی که حاوی مقدار زیادی آبی هستند ( از بنفش تا سبز) ، نسبت به رنگ هایی که زرد یا قرمز بیشتری در خود دارند (از مغز پسته ای تا ارغوانی) ، سردتر می نمایند . رنگ های سرد ، مختصر کاهش در دمای بدن نگرنده ایجاد می کنند و رنگ های گرم باعث مختصر افزایش دمای بدن می شوند . به لحاظ بصری ، رنگ گرم پیش می آید و رنگ سرد پس می نشیند . بسیاری از نقاشان از این کیفیت رنگ ها برای فضا سازی تصویری بهره گرفته اند . منشأ احساس هایی چون گرمی ، سردی ، پیش آیندگی ، پس روندگی ، وزن و اندازه ی رنگ ها – که اصطلاحاتی رایج در ادبیات هنرهای تجسمی اند) همانا سه صفت اساسی رنگ ، یعنی فام ، درخشندگی و اشباع است .
نقاشان قدیم بسیاری از نمودها و اثرات بصری رنگ را بدون شناخت علمی به کار می بستند ، ولی انتشار نظریه های رنگ ، نقاشان پُست امپرسیونیسم ،اُرفیسم و آپ آرت را بر آن داشت که امکانات بیانی و تزیینی رنگ را گسترش دهند و به راه حل های تازه ای در مسائل حجم ، فضا ، نور و حرکت دست یابند . رنگ در تلویزیون
نمای نزدیک
اگر بخشی از صفحه تلویزیون رنگی را بزرگ کنیم،
می توانید ببینید که تصویر آن از نوارهای
متعدد و ریزی به رنگهای قرمز، سبز،
و آبی تشکیل شده است.
تصویر در تلویزیون رنگی از نوارهای ریز متعددی از رنگهای اصلی نور یعنی قرمز ،سبز ، و آبی تشکیل می شود . این نوارها سطوح درخشندگی مختلفی دارند . وقتی به صفحه تلویزیون نگاه می کنیم ، چشم این نوارها را با هم مخلوط می کند و یک تصویر واحد با انواع مختلف رنگها را می بیند.از فاصله دید معمولی ، نوارهای نور روی صفحه ترکیب می شوند و یک تصویر دقیق تمام رنگی را تشکیل می دهند.
فرایند تصعید
فرایند تصعید
آنتالپی مولی تصعیدآنتالپی مولی تصعید ، مقدار گرمایی است که بایستی به یک مول از ماده جامد داده شود تا مستقیما به گاز تبدیل گردد. فشار بخار یک جامد و فرایند تصعیدمولکولها در یک بلور ، حول محور خود در شبکه نوسان میکنند. توزیع انرژی جنبشی بین این مولکولها نظیر توزیع انرژی جنبشی بین مولکولهای مایع و گاز است. در یک بلور ، انرژی از مولکولی به مولکول دیگر منتقل میشود و از اینرو انرژی هیچ مولکولی ثابت نیست. مولکولهای پرانرژی در سطح بلور میتوانند بر نیروهای جاذبه بلور غلبه کرده، به فاز بخار بگریزند.
اگر بلور در یک ظرف سربسته باشد، سرانجام حالت تعادلی برقرار میشود که در آن حالت ، سرعت جدا شدن مولکولها از جامد با سرعت بازگشت مولکولهای بخار به بلور برابری میکند. فشار بخار یک جامد در دمای معین ، معیاری از تعداد مولکولها در حجم معینی از بخار در حالت تعادل است. ارتباط فشار بخار با نیروهای جاذبهگرچه فشار بخار برخی از جامدات ، بسیار کم است، ولی هر جامدی دارای فشار بخار است. مقدار فشار بخار با قدرت نیروهای جاذبه نسبت عکس دارد. به همین علت ، فشار بخار بلورهای یونی بسیار کم است. ارتباط فشار بخار جامد با دماتوانایی مولکولها برای غلبه بر نیروهای جاذبه بین مولکولها با انرژی جنبشی آنها بستگی دارد. از اینرو ، فشار بخار جامدات با افزایش دما زیاد میشود. منحنی تغییرات فشار بخار برحسب دما نشان میدهد که این منحنی در نقطه انجماد ، منحنی فشار بخار آب را قطع میکند. فشار بخار جامد در نقطه انجماددر نقطه انجماد ، فشار بخار جامد برابر با فشار بخار مایع است. نقطه انجماد نرمال آب (در فشار کل یک اتمسفر) در غیاب هوا 25x10-4 درجه سانتیگراد است. ولی در هوا و در فشار کل یک اتمسفر نقطه انجماد آب 0.0000درجه سانتیگراد میباشد و این مقداری است که معمولا گزارش میشود. این اختلاف در نقطه انجماد ، از هوای محلول در آب ناشی میشود.
نقطه انجماد مواد ، معمولا در هوا اندازهگیری میشود. ولی در هر حال ، تغییر انجماد مواد ناشی از وجود هوا عموما بسیار ناچیز است. تصعید دیاکسید کربننمودار فاز دیاکسید کربن ، گونهای از نمودار فاز موادی است که در فشار معمولی به جای ذوب شدن و جوشیدن تصعید میشوند. در فشار 5.11 اتمسفر نقطه سه گانه سیستم دیاکسید کربن ، 55.6 - درجه سانتیگراد است. دیاکسید کربن مایع ، تنها در فشارهای بالاتر از 5.11 اتمسفر وجود دارد. اگر دیاکسیدکربن جامد (یخ خشک) را تحت فشار یک اتمسفر گرم کنیم، در دمای 78.5 - درجه سانتیگراد مستقیما به گاز تبدیل میشود
تبخیر
مولکولهای که انرژی جنبشی آنها به قدر کافی زیاد است میتوانند بر نیروهای جاذبه مولکولهای اطراف خود غلبه کنند. این مولکولها میتوانند از سطح مایع فرار کنند و به فاز گاز وارد شوند به شرط آنکه نزدیک به سطح مایع و در جهت مناسب در حرکت باشند.
این مولکولها در حین فرار از مایع ، بخشی از انرژی خود را برای مقابله با نیروهای جاذبه مصرف میکنند. فرار تعدادی از مولکولهای با انرژی زیاد از مایع سبب میشود که انرژی جنبشی متوسط مولکولهای باقی مانده در مایع کاهش یابد و از دمای مایع کاسته شود. وقتی که مایعی از یک ظرف سرباز تبخیر میشود،انتقال گرما از محیط به مایع صورت میگیرد و در نتیجه ، دمای مایع ثابت میماند و به این ترتیب ، ذخیره مولکولهای پر انرژی تامین میشود و این فرایند تا تبخیر تمام مایع ادامه مییابد. آنتالپی تبخیر مولیمقدار کل گرمای لازم برای تبخیر یک مول از مایع در دمای معین ، آنتالپی تبخیر مولی آن مایع نامیده میشود. اثر دما بر تبخیربا افزایش دمای مایع سرعت تبخیر زیاد میشود. وقتی دما افزایش مییابد، انرژی جنبشی متوسط مولکولها زیاد میشود و تعداد مولکولهای با انرژی کافی برای فرار به فاز گازی افزایش مییابد. از کاربردهای تبخیر
تنظیم دمای بدن: تنظیم دمای بدن ، تا حدودی، بر اثر عرق در پوست صورت میگیرد.
ساخت وسائل خنک کننده گوناگون با استفاده از مکانیزم تبخیر
کوزه سفالی بدون لعاب که برای خنک نگه داشتن آب بکار می رود. آب ، گل کوزه را سیر کرده از سطح خارجی آن بخار میشود. با این عمل ، آب باقیمانده در کوزه خنک میگردد.
مسئله
مسئله کوله پشتی چیست؟
فرض کنید که جهانگردی می خواهد کوله پشتی خود را با انتخاب حالتهای ممکن از بین وسائل گوناگونی که بیشترین راحتی را برایش فراهم می سازند پر کند. این مسئله می تواند با شماره گذاری این وسائل از 1 تا n و تعریف برداری از متغیرهای دودویی(Binary) (j 1,2,...n) بصورت ریاضی فرمول بندی شود. به این معنی که: اگر شی ء j ام انتخاب شود در غیر اینصورت وقتی میزان راحتی باشد که وسیله j ا م فراهم می آورد و وزن آن و c اندازه کوله پشتی باشد. مسئله ما انتخاب برداری از بین بردارهای دودویی x است،که محدودیت را بر آورده کند. بطوریکه تابع هدف ماکزیمم مقدار خود را بگیرد به عنوان نمونه ای از مسائلی که می توانند بصورت مساله کوله پشتی فرمول بندی شوند، مسئله زیر را در نظر بگیرید:
فرض کنید که شما مایل به سرمایه گذاری همه یا قسمتی از سرمایه تان باشید. اگر مبلغی که برای سرمایه گذاری در نظر گرفتید c دلار باشد و n مورد برای سرمایه گذاری ممکن باشد ، اجازه دهید که سود حاصل از سرمایه گذاری j ام و مقدار دلار هایی باشد که آن سرمایه گذاری لازم دارد . بدین ترتیب جواب بهینه مسئله کوله پشتی که تعریف کردیم به ما این امکان را می دهد که بهترین حالت ممکن را از بین حالتهای مختلف سرمایه گذاری انتخاب کنیم.
در این رابطه باید روشی برای حل این مسئله پیدا کرد . یک روش ابتدایی که در نگاه اول توجه ما را به خود جلب می کند ، عبارت از برنامه نویسی برای کامپیوتر به منظور امتحان کردن تمامی بردارهای دودویی ممکن x است، تا از بین بردارهایی که محدودیت مسئله را ارضاء می کنند بهترین را انتخاب کند. متاسفانه تعداد چنین بردارهایی است.بطوریکه یک کامپیوتر فرضی که می تواند یک بیلیون بردار را در یک ثانیه امتحان کند؛برای n 60 بیش از 30 سال وقت لازم دارد و بیش از 60 سال برای n 61 و دهها قرن برای n 65 والی اخر.
با این وجود ،با استفاده از الگوریتمهایی خاص می توان در بسیاری موارد مسئله ای با n 100 000 را در عرض چند ثانیه روی یک کامپیوتر کوچک حل کرد.
تبخیر
انرژی جنبشی مولکولهای مایع در تبخیر
انرژی جنبشی مولکول معینی از یک مایع ، ضمن برخورد با سایر مولکولهای پیوسته تغییر میکند. ولی در لحظهای معین ، تعدادی ازمولکولهای یک مجموعه ، تعدادی مولکول دارای انرژی نسبتا زیاد و تعدادی دارای انرژی نسبتا کم هستند. مولکولهای که انرژی جنبشی آنها به قدر کافی زیاد است میتوانند بر نیروهای جاذبه مولکولهای اطراف خود غلبه کنند. این مولکولها میتوانند از سطح مایع فرار کنند و به فاز گاز وارد شوند به شرط آنکه نزدیک به سطح مایع و در جهت مناسب در حرکت باشند.این مولکولها در حین فرار از مایع ، بخشی از انرژی خود را برای مقابله با نیروهای جاذبه مصرف میکنند. فرار تعدادی از مولکولهای با انرژی زیاد از مایع سبب میشود که انرژی جنبشی متوسط مولکولهای باقی مانده در مایع کاهش یابد و از دمای مایع کاسته شود. وقتی که مایعی از یک ظرف سرباز تبخیر میشود،انتقال گرما از محیط به مایع صورت میگیرد و در نتیجه ، دمای مایع ثابت میماند و به این ترتیب ، ذخیره مولکولهای پر انرژی تامین میشود و این فرایند تا تبخیر تمام مایع ادامه مییابد.
آنتالپی تبخیر مولی
مقدار کل گرمای لازم برای تبخیر یک مول از مایع در دمای معین ، آنتالپی تبخیر مولی آن مایع نامیده میشود.اثر دما بر تبخیر
با افزایش دمای مایع سرعت تبخیر زیاد میشود. وقتی دما افزایش مییابد، انرژی جنبشی متوسط مولکولها زیاد میشود و تعداد مولکولهای با انرژی کافی برای فرار به فاز گازی افزایش مییابد.از کاربردهای تبخیر
- تنظیم دمای بدن: تنظیم دمای بدن ، تا حدودی، بر اثر عرق در پوست صورت میگیرد.
- ساخت وسائل خنک کننده گوناگون با استفاده از مکانیزم تبخیر
- کوزه سفالی بدون لعاب که برای خنک نگه داشتن آب بکار می رود. آب ، گل کوزه را سیر کرده از سطح خارجی آن بخار میشود. با این عمل ، آب باقیمانده در کوزه خنک میگردد.
پلاسما
پلاسما حالت چهارمی از ماده است که دانش امروزی نتوانسته آن ها را جزو سه حالت دیگر پندارد و مجبور شده آنرا حالت مستقلی به حساب آورد. پلاسما با ماهیت محیط یونیزه ، ترکیبی از یون های مثبت و الکترون با مقدار معین میباشد که مقدار الکترون ها و یون های مثبت در یک محیط پلاسما تقریباً برابر است و حالت پلاسمای مواد ، تقریبا حالت شبه خنثایی دارد. پدیدههای طبیعی زیادی از جمله آتش ، خورشید ، ستارگان و غیره در رده حالت پلاسمایی ماده قرار میگیرند. پلاسما شبیه به گاز است، ولی مرکب از ذرات باردار متحرکی به نام یون است. یون ها بشدت تحت تاثیر نیروهای الکتریکی و مغناطیسی قرار میگیرند. مواد طبیعی در حالت پلاسما عبارتند از انواع شعله، بخش خارجی جو زمین، اتمسفر ستارگان، بسیاری از مواد موجود در فضای سحابی و بخشی از دم ستاره دنبالهدار. بد نیست بدانید که دانش امروزی حالات دیگری از جمله برهم کنش ( نیروهای ) ضعیف و قوی هستهای را نیز در دستهبندی ها به عنوان حالت های پنجم و ششم ماده به حساب میآورد که از این حالت ها در توجیه خواص نوکلئون های هسته ، نیروهای هستهای ، واکنش های هستهای و در کل فیزیک ذرات بنیادی استفاده میشود. ساختار پلاسما : عموماً به مجموعهای از یون ها ، الکترون ها و اتم های خنثی و جدا از هم پلاسما میگویند. پلاسما از لحاظ بار الکتریکی خنثی است. ماده در حالت پلاسما نسبت به حالت های جامد ، مایع و گاز نظم کم تری دارد. با این حال خنثی بودن الکتریکی پلاسما به طور متوسط انرژی منظمی را نشان میدهد. اگر پلاسما تا دمای زیاد حرارت داده شود، نظم موجود در پلاسما از بین میرود و ماده به توده درهم و برهم و کاملا نامنظم ذرات منفرد تبدیل میشود. بنابراین پلاسما گاهی نظیر سیارات، رفتاری جمعی و گاهی نظیر ذرات منفرد، به صورت کاملاً تکی عمل میکند. به دلیل همین رفتارهای عجیب و غریب است که غالباً پلاسما در کنار گازها و مایعات و جامدات ، چهارمین حالت ماده معرفی میشود. با وجود این پیچیدگیها، با توجه به اینکه 99 درصد ماده موجود در طبیعت و جهان در حالت پلاسماست، بررسی پلاسمای طبیعی ضروری است. پلاسما کاربردهای بسیاری نظیر تولید انرژی و ... دارد. هنگام ترک زمین، با انواع پلاسماها مانند "یونسفر ، کمربندها و بادهای خورشیدی" مواجه میشویم.
تصعید
رآیندی که در آن ، جامد بدون عبور از حالت مایع ، مستقیما به بخار تبدیل میگردد، تصعید نامیده میشود. این فرآیند برگشت پذیر است. 
آنتالپی مولی تصعید
آنتالپی مولی تصعید ، مقدار گرمایی است که بایستی به یک مول از ماده جامد داده شود تا مستقیما به گاز تبدیل گردد. فشار بخار یک جامد و فرایند تصعید
مولکولها در یک بلور ، حول محور خود در شبکه نوسان میکنند. توزیع انرژی جنبشی بین این مولکولها نظیر توزیع انرژی جنبشی بین مولکولهای مایع و گاز است. در یک بلور ، انرژی از مولکولی به مولکول دیگر منتقل میشود و از اینرو انرژی هیچ مولکولی ثابت نیست. مولکولهای پرانرژی در سطح بلور میتوانند بر نیروهای جاذبه بلور غلبه کرده، به فاز بخار بگریزند.
اگر بلور در یک ظرف سربسته باشد، سرانجام حالت تعادلی برقرار میشود که در آن حالت ، سرعت جدا شدن مولکولها از جامد با سرعت بازگشت مولکولهای بخار به بلور برابری میکند. فشار بخار یک جامد در دمای معین ، معیاری از تعداد مولکولها در حجم معینی از بخار در حالت تعادل است. ارتباط فشار بخار با نیروهای جاذبه
گرچه فشار بخار برخی از جامدات ، بسیار کم است، ولی هر جامدی دارای فشار بخار است. مقدار فشار بخار با قدرت نیروهای جاذبه نسبت عکس دارد. به همین علت ، فشار بخار بلورهای یونی بسیار کم است. ارتباط فشار بخار جامد با دما
توانایی مولکولها برای غلبه بر نیروهای جاذبه بین مولکولها با انرژی جنبشی آنها بستگی دارد. از اینرو ، فشار بخار جامدات با افزایش دما زیاد میشود. منحنی تغییرات فشار بخار برحسب دما نشان میدهد که این منحنی در نقطه انجماد ، منحنی فشار بخار آب را قطع میکند. فشار بخار جامد در نقطه انجماد
در نقطه انجماد ، فشار بخار جامد برابر با فشار بخار مایع است. نقطه انجماد نرمال آب (در فشار کل یک اتمسفر) در غیاب هوا 25x10-4 درجه سانتیگراد است. ولی در هوا و در فشار کل یک اتمسفر نقطه انجماد آب 0.0000درجه سانتیگراد میباشد و این مقداری است که معمولا گزارش میشود. این اختلاف در نقطه انجماد ، از هوای محلول در آب ناشی میشود.
نقطه انجماد مواد ، معمولا در هوا اندازهگیری میشود. ولی در هر حال ، تغییر انجماد مواد ناشی از وجود هوا عموما بسیار ناچیز است. تصعید دیاکسید کربن
نمودار فاز دیاکسید کربن ، گونهای از نمودار فاز موادی است که در فشار معمولی به جای ذوب شدن و جوشیدن تصعید میشوند. در فشار 5.11 اتمسفر نقطه سه گانه سیستم دیاکسید کربن ، 55.6 - درجه سانتیگراد است. دیاکسید کربن مایع ، تنها در فشارهای بالاتر از 5.11 اتمسفر وجود دارد. اگر دیاکسیدکربن جامد (یخ خشک) را تحت فشار یک اتمسفر گرم کنیم، در دمای 78.5 - درجه سانتیگراد مستقیما به گاز تبدیل میشود.
تصعید
رآیندی که در آن ، جامد بدون عبور از حالت مایع ، مستقیما به بخار تبدیل میگردد، تصعید نامیده میشود. این فرآیند برگشت پذیر است. 
آنتالپی مولی تصعید
آنتالپی مولی تصعید ، مقدار گرمایی است که بایستی به یک مول از ماده جامد داده شود تا مستقیما به گاز تبدیل گردد. فشار بخار یک جامد و فرایند تصعید
مولکولها در یک بلور ، حول محور خود در شبکه نوسان میکنند. توزیع انرژی جنبشی بین این مولکولها نظیر توزیع انرژی جنبشی بین مولکولهای مایع و گاز است. در یک بلور ، انرژی از مولکولی به مولکول دیگر منتقل میشود و از اینرو انرژی هیچ مولکولی ثابت نیست. مولکولهای پرانرژی در سطح بلور میتوانند بر نیروهای جاذبه بلور غلبه کرده، به فاز بخار بگریزند.
اگر بلور در یک ظرف سربسته باشد، سرانجام حالت تعادلی برقرار میشود که در آن حالت ، سرعت جدا شدن مولکولها از جامد با سرعت بازگشت مولکولهای بخار به بلور برابری میکند. فشار بخار یک جامد در دمای معین ، معیاری از تعداد مولکولها در حجم معینی از بخار در حالت تعادل است. ارتباط فشار بخار با نیروهای جاذبه
گرچه فشار بخار برخی از جامدات ، بسیار کم است، ولی هر جامدی دارای فشار بخار است. مقدار فشار بخار با قدرت نیروهای جاذبه نسبت عکس دارد. به همین علت ، فشار بخار بلورهای یونی بسیار کم است. ارتباط فشار بخار جامد با دما
توانایی مولکولها برای غلبه بر نیروهای جاذبه بین مولکولها با انرژی جنبشی آنها بستگی دارد. از اینرو ، فشار بخار جامدات با افزایش دما زیاد میشود. منحنی تغییرات فشار بخار برحسب دما نشان میدهد که این منحنی در نقطه انجماد ، منحنی فشار بخار آب را قطع میکند. فشار بخار جامد در نقطه انجماد
در نقطه انجماد ، فشار بخار جامد برابر با فشار بخار مایع است. نقطه انجماد نرمال آب (در فشار کل یک اتمسفر) در غیاب هوا 25x10-4 درجه سانتیگراد است. ولی در هوا و در فشار کل یک اتمسفر نقطه انجماد آب 0.0000درجه سانتیگراد میباشد و این مقداری است که معمولا گزارش میشود. این اختلاف در نقطه انجماد ، از هوای محلول در آب ناشی میشود.
نقطه انجماد مواد ، معمولا در هوا اندازهگیری میشود. ولی در هر حال ، تغییر انجماد مواد ناشی از وجود هوا عموما بسیار ناچیز است. تصعید دیاکسید کربن
نمودار فاز دیاکسید کربن ، گونهای از نمودار فاز موادی است که در فشار معمولی به جای ذوب شدن و جوشیدن تصعید میشوند. در فشار 5.11 اتمسفر نقطه سه گانه سیستم دیاکسید کربن ، 55.6 - درجه سانتیگراد است. دیاکسید کربن مایع ، تنها در فشارهای بالاتر از 5.11 اتمسفر وجود دارد. اگر دیاکسیدکربن جامد (یخ خشک) را تحت فشار یک اتمسفر گرم کنیم، در دمای 78.5 - درجه سانتیگراد مستقیما به گاز تبدیل میشود.
عدد پی
 |
عدد پی عددگنگی است که در اکثر محاسبات ریاضی به نحوی حضور دارد و از مهمترین اعداد کاربردی در ریاضیات میباشدو آن را با 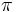 نمایش میدهند. در هندسه اقلیدسی دو بعدی، این عدد را نسبت محیط دایره به قطر دایره و یا مساحت دایره ای به شعاع واحد تعریف میکنند. در ریاضیات مدرن این عدد را در علم آنالیز و با استفاده از توابع مثلثاتی ، به صورت دقیق ریاضی تعریف میکنند.به عنوان نمونه عدد پی رادو برابر کوچکترین مقدار مثبت x ،که به ازای آن cos(x)=0 میشود تعریف میکنند. نمایش میدهند. در هندسه اقلیدسی دو بعدی، این عدد را نسبت محیط دایره به قطر دایره و یا مساحت دایره ای به شعاع واحد تعریف میکنند. در ریاضیات مدرن این عدد را در علم آنالیز و با استفاده از توابع مثلثاتی ، به صورت دقیق ریاضی تعریف میکنند.به عنوان نمونه عدد پی رادو برابر کوچکترین مقدار مثبت x ،که به ازای آن cos(x)=0 میشود تعریف میکنند. |
تاریخچه
بابلیان هنگامی که میخواستند مساحت دایره را حساب کنند،مربع شعاع آن را در 3 ضرب میکردند.البته لوحهای قدیمی تری از بابلیان وجود دارد که مشخص میکند آنها مقدار تقریبی پی را برابر3.125 میدانستند.در مصر باستان مساحت دایره را با استفاده از فرمول محاسبه میکردند.( d قطر دایره در نظر گرفته میشد )که در نتیجه مقدار تقریبی عدد پی 3.1605 بدست میآید.
محاسبه میکردند.( d قطر دایره در نظر گرفته میشد )که در نتیجه مقدار تقریبی عدد پی 3.1605 بدست میآید. 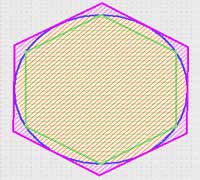 |
تقریب اعشاری عدد پی
اولین نظریه در مورد مقدار تقریبی عدد پی توسط ارشمیدس بیان شد.این نظریه بر پایه تقریب زدن مساحت دایره بوسیله یک شش ضلعی منتظم محیطیو یک شش ضلعی منظم محاطی استوار است. ریاضیدانان اروپایی در قرن هفدهم به مقدار واقعی عدد پی نزدیکتر شدند.از جمله این دانشمندان جیمز گریگوری بود که برای پیدا کردن مقدار عدد پی از فرمول زیر استفاده کرد: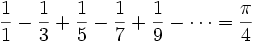
یکی از مشکلاتی که در این روش وجود دارد این است که برای پیدا کردن مقدار عدد پی تا 6 رقم اعشار باید پنج میلیون جمله از سری فوق را با هم جمع کنیم.
در اوایل قرن هجدهم ریاضیدان دیگری به نام جان ماشین فرمول گریگوری را اصلاح کرد که این فرمول امروزه نیز در برنامه های رایانه ای برای محاسبه عدد پی مورد استفاده قرار میگیرد.
این فرمول به صورت زیر است:
 |
با استفاده از این فرمول یک انگلیسی به نام ویلیام شانکس مقدار عدد پی را تا 707 رقم اعشار محاسبه کرد،در حالیکه فقط 527رقم آن درست بود.
امروزه مقدار عدد پی با استفاده از پیشرفته ترین رایانه ها تا میلیونها رقم محاسبه شده است. و تعداد این ارقام هنوز در حال افزایش است.
هفت خان اسفندیار
هفت خوان اسفندیار در زمان سلطنت گُشتاسپ جنگ هایی میان ایران و ارجاسبِ تورانی در می گیرد . طیّ این جنگ ها دو دختر گُشتاسپ _ همای و به آفرید _ به اسارت ارجاسب ١_ در نخستین خوان با دو گرگ می جنگد و آنها را به هلاکت می رساند . ٢_ خوان دوم ، جنگ با دو شیر است که به دست وی از پا می افتند . ٣_ در خوان سوم اژدهایی را از بین می برد ؛ برای این کار بر بدنۀ یک صندوق تیرهایی می نشاند و آن را بر گردونه ای سوار می کند . خود به درون صندوق می رود و با اژدها ۴_ اسفندیار در حالی که آواز می خواند و تنبور می نوازد ، به جایگاه زنِ جادو می رود . پس از پدیدار شدن زن ، اسفندیار در فرصتی مناسب و با زنجیری که از بهشت است و بر بازوی خویش بسته ، او را به دام می اندازد . زن جادوگر در اسارت پهلوان ، به پیرزنی زشت روی تبدیل می شود و با خنجر اسفندیار از پای در می آید . در همان دم بادی سیاه بر می خیزد و آسمان در تیرگی فرو می رود . ۵_ اسفندیار صندوق و گردونه ( خوان چهارم ) را برای جنگی که با سیمرغ دارد ، به کار می برد و بر این موجود نیز غلبه می کند .* ۶_ او و همراهانش مجبور می شوند از برف و سرما عبور کنند . سه روز و سه شب برفِ تیره بر آنها می بارد . همه دست به دعا بر می دارند و از این خوان هم به سلامت ٧_ گرگسار ، از روی نیرنگ ، خوان هفتم را بیابانی خشک و بی آب و علف توصیف * در شاهنامه به غیر از آن سیمرغ که جلوۀ مثبت و روحانی دارد ، سیمرغ با جلوۀ منفی هم توصیف شده است .
در می آیند . گشتاسپ از پسرش اسفندیار می خواهد که آن دو را از زندان رویین دژ برهاند . اسفندیار به همراه برادرش ، پَشوتن ، و دوازده هزار سپاهی از بلخ به راه
می افتند و گُرگسار نیز به عنوان رهنمون همراه آنهاست . بر سر یک دوراهی و پس از پرسش از گرگسار ، مشخص می شود اسفندیار سه راه در پیش رو دارد که کوتاه ترین راه ، دشوارترین آنهاست . اسفندیار با گزینش راه کوتاه تر ، از هفت تنگنا عبور می کند و به رویین دژ می رسد .
رو به رو می شود .
می گذرند .
می کند . امّا اسفندیار و همراهانش در تاریکی به دریای ژرفی می رسند . طلایۀ سپاه او در آب می افتد و اسفندیار نجاتش می دهد . گرگسار با مژدۀ بخشایش از سوی اسفندیار ، از وی پوزش می خواهد و سپس آنها را راهنمایی می کند تا از آب بگذرند .